已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
 则表中a为() A.404 B.260 C.230 D.200 【考试结果】有78.3%的同学按下述思路解题而错选A H2(g)+Br2(l)=2HBr(g)ΔH=-72kJ/mol① Br2(1)=Br2(g)ΔH=30kJ/mol② 热化学方程式①-热化学方程式②得 H2(g)+Br2(g)=2HBr(g)ΔH=-102kJ/mol 所以369×2-(a+436)=-102得a=404 问题: (1)本题正确答案是(),正确解题思路是什么? (2)试对学生解题错误形成的原因进行分析。
则表中a为() A.404 B.260 C.230 D.200 【考试结果】有78.3%的同学按下述思路解题而错选A H2(g)+Br2(l)=2HBr(g)ΔH=-72kJ/mol① Br2(1)=Br2(g)ΔH=30kJ/mol② 热化学方程式①-热化学方程式②得 H2(g)+Br2(g)=2HBr(g)ΔH=-102kJ/mol 所以369×2-(a+436)=-102得a=404 问题: (1)本题正确答案是(),正确解题思路是什么? (2)试对学生解题错误形成的原因进行分析。

在298K时,H2(g)+(1/2)O2(g)=H2O(L),△H=-285.8kJ/mol。若温度升高,则有下列中何种变化()?
已知反应2H2O(g)=2H2(g)+O2(g)的平衡常数为,反应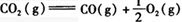 的平衡常数为,则反应()
的平衡常数为,则反应()
下述3个反应:
(1)S(s)+O2(g)→SO2(g)
(2)H2(g)+O2(g)→H2O2(g)
(3)C(s)+H2O(g)→CO2(g)+H2(g)
按ΔrSθm增加的顺序为()。
免费的网站请分享给朋友吧